医疗界 “超级大脑”——数字病理大模型重塑精准医疗未来
数字病理大模型
在医疗科技飞速发展的当下,数字病理学领域正经历着一场前所未有的变革。顶刊聚焦之处,各大创新病理大模型不断涌现,为疾病诊断、研究和治疗开辟了全新路径。从哈佛医学院的系列模型,到国内瑞金医院的成果,每一次突破都让我们离精准医疗的目标更近一步。今天,就让我们深入探寻这些引领行业的病理大模型
浙大一院 OmniPT发布
开启 AI 病理诊断新时代
2024 年,浙江大学医学院附属第一医院发布了视觉与语言模型融合的人机交互 AI 病理万能助手 ——OmniPT。该模型由浙大计算机学院宋明黎教授团队联合浙大一院共同开发,双方自 2020 年深度合作,历经申请数字病理人工智能医疗器械临床试验中心、获批人工智能医疗器械创新任务揭榜挂帅优胜单位等重要阶段。
OmniPT 围绕临床痛点,通过跨层级高效特征锁定、提示引导细节特征补全等技术,解决了 GB 级超大尺寸病理图秒级推理、精准分析难题,实现多类型诊断任务全覆盖。它能在 1 - 3 秒内准确锁定病灶区域,在十余个癌种上诊断准确性超 95%,支持多种便捷交互方式,还能精准识别肿瘤微环境,在多个癌种上达到 80 - 90% 预后精准预测,挖掘新型标志物。目前,OmniPT 已在浙大一院病理科多个高发病率癌种率先应用,有效提升了诊断效率和质量,缓解了病理人才匮乏的问题,推动了 AI 技术在病理临床实践的应用,为患者带来更精准高效的医疗服务 。其中,江丰生物在技术和数据层面提供了坚实的支撑,未来我们也将继续在智慧病理领域发光发热。
瑞金医院瑞智病理大模型RuiPath
国产创新引领变革
2025 年 2 月 18 日,上海交通大学医学院附属瑞金医院携手华为发布了瑞智病理大模型 RuiPath。该模型基于瑞金医院数字化智慧病理科全业务流程开发,是临床级国产多模态互动式病理大模型 。
依托瑞金医院百万级数字病理切片库,RuiPath 拥有丰富的数据模态,涵盖图像、文本等多领域,维度广泛,基于多学科且涵盖患者全生命周期,标签完备,包含影像、检验、病理等数据标签。它覆盖了中国每年 90% 癌症发病人群罹患的癌种,在亚专科知识问答上达到专家级水平,回答准确率超 90%。在医学考试场景的图文问答任务中,处于国内外领先水平。而且,单切片 AI 诊断时间仅需数秒,大大提升了医生的诊断效率,让医生从繁重的 “逐片诊断” 工作中解脱出来,转变为更高效的 “逐步审核” 模式。比如在日常的癌症筛查诊断中,医生借助 RuiPath 可以快速对大量切片进行初步分析,精准定位可疑区域,再进行细致审核,大大缩短了诊断周期,提高了诊断质量。
从浙大一院的OmniPT到瑞金医院的瑞智病理大模型RuiPath,我们看到了国产创新在病理领域的不断突破。而在全球舞台上,同样有着令人瞩目的成果,让我们继续深入了解。
01
PathChat DX
获 FDA 认可的诊断助手
美国 Modella AI 公司开发的 PathChat DX 在 2025 年获得美国 FDA 突破性设备认定,这是全球首款基于生成式 AI 的人类病理学辅助诊断工具 。它基于《Nature》杂志发表的 PathChat 模型升级,整合了病理图像分析与病理报告文本解读能力。
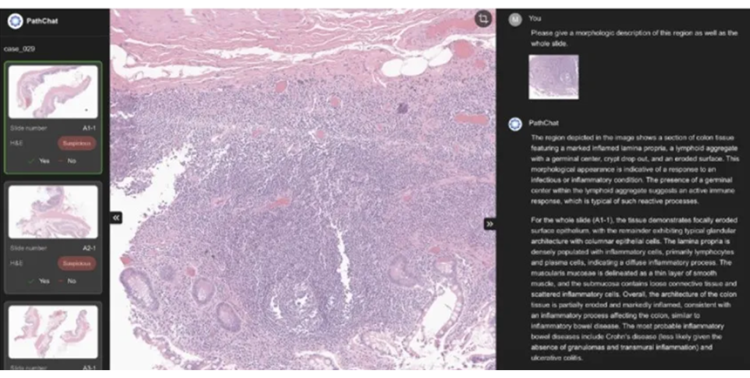
其底层运用病理基础大模型(预训练超大规模组织图像库)与多模态大语言模型(MLLM),能够解析高精度病理切片图像以及患者数据。在实际应用中,不同病理医生对同一切片的诊断可能存在主观差异,PathChat DX 可以提供客观的分析参考,减少这种差异。同时,面对全球日益增长的癌症筛查需求,它能快速处理大量切片,缓解病理医生的工作压力和倦怠情绪,辅助医生做出更准确、高效的诊断决策。
02
H - Optimus - 0
助力药物研发的病理模型
法国 AI 独角兽 Bioptimus 公司于 2025 年开发的 H - Optimus - 0,是专为病理学设计的基础大模型 。该模型在数百万张病理图像上进行训练,主要用于支持癌症等疾病的研究和诊断。
目前,Bioptimus 公司计划以 H - Optimus - 0 为基础,进一步整合多模态生物数据,如基因组学、蛋白质组学等,并与欧洲顶级研究机构合作。在药物研发过程中,通过分析病理图像与其他生物数据的关联,能够更深入了解疾病机制,加速药物研发进程,为个性化医疗提供有力支持。例如在针对某种罕见癌症的药物研发中,H - Optimus - 0 可以对大量病理图像进行分析,找出潜在的药物作用靶点,结合基因组学数据,为筛选合适的药物分子提供方向,缩短研发周期。
03
PathOrchestra
多任务、高准确的国产模型
2024 年 7 月,空军军医大学病理学科研团队联合清华大学和商汤医疗共同发布了 PathOrchestra 。它基于国内规模最大的数字病理图像数据集训练,数据量近 30 万张、近 300tb,还融合了文本、视频等多模态训练数据。
通过自监督学习,PathOrchestra 无需大量精标注数据即可分析各类器官病理图像。目前已覆盖肺、乳腺、肝脏、食管等20余种器官,可应用于泛癌分类、病灶识别和检测、多癌种亚型分类、生物标志物评估等百余项临床任务。在多器官泛癌分类、淋巴瘤亚型诊断、膀胱癌筛查等近 50 项任务中,准确率超过 95%。在一次针对某地区高发癌症的筛查项目中,PathOrchestra 快速准确地对大量样本进行泛癌分类,为后续的精准诊断和治疗提供了重要依据,大大提高了筛查效率和准确性。
04
CHIEF
癌症检测与预后预测的利器
2024年9月4日来自哈佛医学院的研究团队开发了名为“CHIEF”(Clinical Histopathology Imaging Evaluation Foundation)的通用机器学习框架,该方法以《A pathology foundation model for cancer diagnosis and prognosis prediction》为题发表在《Nature》杂志上,是临床组织病理学成像评估基础模型 。它面对包含11种癌症类型的15个数据库样本时,其预测评价指标AUROC达到了0.9397,同时是第一个能够预测患者预后生存率的模型。

在临床应用中,CHIEF 不仅可以帮助医生准确检测癌症,还能为患者的治疗方案制定提供重要参考。例如对于一位确诊为癌症的患者,CHIEF 可以根据病理图像等信息预测其预后生存率,医生可以根据这个预测结果,结合患者的身体状况,制定更合理的治疗方案,如选择激进的治疗方式还是保守治疗,以提高患者的生存质量和生存期。
CHIEF代码链接:https://github.com/hms-dbmi/CHIEF
05
UNI
解剖病理的通用模型
2024 年 3 月由哈佛医学院发布的 UNI,是基于视觉 Transformer 架构的通用自监督视觉编码器,用于解剖病理学 。它在 34 项临床任务中表现出色,在 43 类 OncoTree 癌症类型分类(OT - 43)和 108 类 OncoTree 代码分类(OT - 108)的切片级任务中,对罕见癌症分类性能显著优于其他预训练编码器。
UNI 能实现 ROI 级别的分类、分割、检索和原型制作,以及切片级别的分类任务。例如在对一些罕见癌症的诊断中,UNI 凭借其强大的特征提取和分类能力,可以准确识别出病变组织,为医生提供关键的诊断线索,而其他模型在面对此类罕见病例时可能表现不佳。
UNI代码链接:https://github.com/mahmoodlab/UNI
06
CONCH
视觉语言交互的新探索
同样在 2024 年 3 月发布的 CONCH,是哈佛医学院推出的视觉语言基础模型 。它的训练数据超过 117 万个图像 - 文本对,这使得病理学家可以与模型交互以搜索感兴趣的形态。
在实际病理诊断工作中,病理学家可以通过输入文本描述,快速在大量病理图像数据中找到相似形态的图像,辅助诊断。比如当医生遇到一种较为特殊的病理形态时,通过 CONCH 可以快速检索出历史上相似的病例图像及相关诊断信息,为当前诊断提供参考,拓宽诊断思路。
CONCH代码链接:https://github.com/mahmoodlab/CONCH
07
TITAN
多模态生成病理报告的先锋
2024 年 12 月发布的 TITAN,是哈佛医学院的多模态 WSI 基础模型 。它无需微调或临床标签,就能提取通用 WSI 表示并生成能够泛化到预训数据资源有限的临床场景的病理报告,如罕见疾病检索和癌症预后。
在罕见疾病的诊断中,由于数据资源有限,很难获取大量的标注数据进行模型训练。TITAN 可以凭借其多模态的特性,从有限的病理图像和其他相关数据中提取关键信息,生成病理报告,为医生提供诊断参考。在一些偏远地区的医院,当遇到罕见病患者时,即使缺乏大量的临床数据,TITAN 也能根据有限的检测信息生成有价值的病理报告,帮助医生初步判断病情。
TITAN代码链接:https://github.com/mahmoodlab/TITAN
这些病理大模型的出现,极大地推动了数字病理学乃至整个医疗行业的发展。它们提高了疾病诊断的准确性和效率,为药物研发提供了新的思路和方法,加速了个性化医疗的进程。在未来,随着技术的不断进步,病理大模型有望在更多领域发挥作用,如与远程医疗结合,让偏远地区的患者也能享受到顶级的病理诊断服务;进一步整合多模态数据,实现对疾病更全面、深入的理解;不断优化算法和模型架构,提高模型的泛化能力和性能,有效地服务于人类健康。